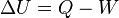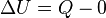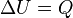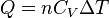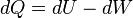En termodinámica se designa como proceso adiabático a aquél en el cual el sistema (generalmente, un fluido que realiza un trabajo) no intercambia calor con su entorno. Un proceso adiabático que es además reversible se conoce como proceso isoentrópico. El extremo opuesto, en el que tiene lugar la máxima transferencia de calor, causando que la temperatura permanezca constante, se denominaproceso isotérmico.
El término adiabático hace referencia a elementos que impiden la transferencia de calor con el entorno. Una pared aislada se aproxima bastante a un límite adiabático. Otro ejemplo es la temperatura adiabática de llama, que es la temperatura que podría alcanzar una llama si no hubiera pérdida de calor hacia el entorno. En climatización los procesos de humectación (aporte de vapor de agua) son adiabáticos, puesto que no hay transferencia de calor, a pesar que se consiga variar la temperatura del aire y su humedad relativa.
El calentamiento y enfriamiento adiabático son procesos que comúnmente ocurren debido al cambio en la presión de un gas. Esto puede ser cuantificado usando la ley de los gases ideales.
En otras palabras se considera proceso adiabático a un sistema especial en el cual no se pierde ni tampoco se gana energía calorífica. Esto viene definido según la primera ley de termodinámica describiendo que Q=0
Si se relaciona el tema del proceso adiabático con las ondas, se debe tener en cuenta que el proceso o carácter adiabático solo se produce en las ondas longitudinales
Formulación matemática
La ecuación matemática que describe un proceso adiabático en un gas es
donde P es la presión del gas, V su volumen y
el coeficiente adiabático, siendo  el calor específico molar a presión constante y
el calor específico molar a presión constante y  el calor específico molar a volumen constante. Para un gas monoatómico ideal,
el calor específico molar a volumen constante. Para un gas monoatómico ideal, 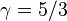 . Para un gas diatómico (como el nitrógeno o el oxígeno, los principales componentes del aire)
. Para un gas diatómico (como el nitrógeno o el oxígeno, los principales componentes del aire) 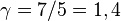
 el calor específico molar a presión constante y
el calor específico molar a presión constante y  el calor específico molar a volumen constante. Para un gas monoatómico ideal,
el calor específico molar a volumen constante. Para un gas monoatómico ideal, 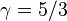 . Para un gas diatómico (como el nitrógeno o el oxígeno, los principales componentes del aire)
. Para un gas diatómico (como el nitrógeno o el oxígeno, los principales componentes del aire) 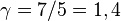


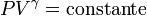
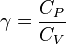

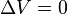 . Esto implica que el proceso no realiza trabajo presión-volumen, ya que éste se define como:
. Esto implica que el proceso no realiza trabajo presión-volumen, ya que éste se define como: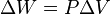 ,
,